FDA希望更多信息范围与“超级细菌”暴发(更新)

联邦卫生官员周四发布了多个公告旨在解决日益增长的安全担忧医疗范围,与最近的一些“超级细菌”的爆发。
美国食品和药物管理局发布了可重用的医疗器械,制造商更严格的指导方针包括专业内窥镜用于每年大约50美国医疗程序。
FDA要求制造商首次提交科学数据显示,他们的设备可以安全消毒。FDA官员承认,1996年以前的机构指南中没有这样的公司的请求。
”,而他们可以证明他们已经完成或完成验证营销之前,”威廉姆·迈希尔博士说FDA医疗器械中心主任。
此外,该机构宣布了一个为期两天的会议在5月中旬来收集专家意见改进设计和所谓的duodenoscopes监管。专业内视镜由一个灵活的光纤管,插入喉咙,通过胃和小肠诊断和治疗胰腺和胆管的条件。
政府宣布之际,不断升级的批评FDA的监管难以清洁设备,已联系有时致命的抗药性细菌的爆发几家医院。上周10个国会议员要求FDA回答关于设备的问题,包括该机构如何审查制造商的清洗指令。
FDA多年来一直致力于新设备指南和之前发布了一份草案在2011年。该机构的首席科学家,斯蒂芬•总裁博士告诉记者,美国食品及药物管理局“加速步伐,因为最近的事件”。
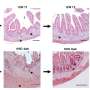
在过去一个月,两个洛杉矶医院报道超级细菌感染患者尽管遵循制造商的清洁。duodenoscopes的复杂design-intended帮助医生排出液体的身体使仪器很难清洁。体液和其他粒子可以在设备的裂缝即使清洁和消毒。
在第一种情况下,7个病人在罗纳德·里根加州大学洛杉矶分校医疗中心做内窥镜手术后感染细菌的耐药菌株与设备由奥林巴斯(Olympus corp .)两个病人死于感染。上周另一个洛杉矶医院,西奈医疗中心,报道,四个病人感染相同的超级细菌处理后奥林巴斯范围。
此前FDA推荐医院按照制造商的说明消毒设备,通常涉及到杀菌消毒剂的使用和手动或machine-assisted处理。但是两个最近爆发的第一次之后,FDA承认这些指令可能不会完全消毒设备。
FDA官员周四说,他们正在努力了解设备可以改善,但FDA强调,不能强迫制造商重新设计产品。
此外,外部专家表示,任何更新设备实际上可能需要数年的时间才能达到市场。
“不幸的是,它会让制造商花一些时间来设计一个不同的方式来做到这一点,”Chris Lavanchy说工程主管ECRI研究所,研究医疗产品的问题。”然后需要FDA时间确认这是一个安全的方式。”
一些医院已经采用了额外的清洁程序,包括与有毒环氧乙烷气体灭菌作用域。其他措施包括隔离范围使用后,进行实验室测试来识别任何危险的细菌。
美国食品和药物管理局和美国疾病控制和预防中心发布周四在实验室培养医院临时指导方针。
技术已成为越来越普遍在欧洲,澳大利亚和其他地方,但它是更昂贵的比美国目前的实践。专家说常规培养的设备需要美国医院购买更大的范围,可以骑车库存的使用。一个duodenoscope成本约40000美元。
污染问题已报告设备由三个美国制造商的设备:奥林巴斯、宾得医疗和富士胶片。
尽管存在这些问题,监管机构强调,使用的设备是必不可少的治疗肿瘤,胆结石和其他在胰腺、胆管阻塞。
“这是一个低风险的方式诊断和治疗这些非常严重的医疗问题,“总裁说。“因此这是至关重要的,我们从A到Z,直到我们检查这个问题想出解决方案,将加强与duodenoscopes相关联的安全裕度。”
©2015美联社。保留所有权利。