NCOA3研究发现黑色素瘤进展的新发现
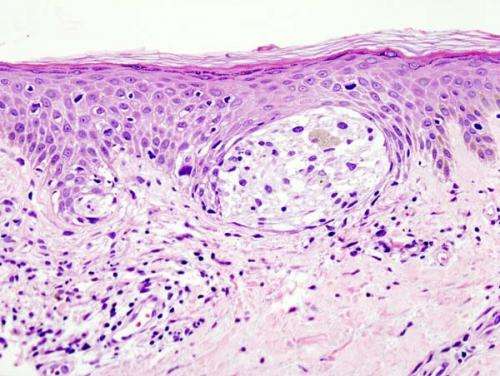
核受体共激活因子3 (NCOA3)的激活首次被证明可以通过调节紫外线辐射(UVR)敏感性、细胞周期进展和规避DNA损伤反应来促进黑色素瘤的发展。Mohammed Kashani-Sabet,医学博士,萨特加州太平洋医疗中心(CPMC)癌症中心的医学主任,领导的一项临床前研究的结果今天在网上发表癌症研究,美国癌症研究协会的期刊。
“我们的研究提示了一个之前未报道的机制,NCOA3调节DNA损伤反应,并作为一个潜在的治疗靶点黑素瘤卡沙尼·萨比特博士说。他与CPMC研究所、德国杜伊斯堡-埃森大学(University Duisburg-Essen)和波特兰奈特癌症研究所(Knight Cancer Institute)的科学家合作,也参与了这项研究。
流行病学研究表明,紫外线辐射在黑素瘤发病中的作用,全基因组测序研究证实了紫外线信号突变的高负担。但紫外线照射后黑色素瘤发展的确切分子机制仍不清楚,因此需要识别控制紫外线和黑色素瘤易感性的额外分子因素。
NCOA3(也称为AIB1或SRC-3)是核激素受体共激活因子家族成员,并调控基因表达通过与各种转录因子的相互作用。最初发现NCOA3在乳房中被放大癌症在各种实体肿瘤中均有致癌作用。然而,NCOA3在紫外线介导的黑素瘤发生中所起的作用之前并未得到证实。
通过利用体外、体内和黑素瘤发生的PDX模型的组合,Kashani博士和同事评估了调节NCOA3在人类黑素瘤细胞和黑素细胞中的表达的影响,识别了NCOA3在黑素瘤进展中调控的多个致癌通路。
结果表明,通过遗传沉默或小分子抑制的NCOA3表达的下调,显着抑制了黑色素瘤细胞系和PDX的黑色素瘤增殖。NCOA3沉默抑制了Xeroderma Pigmentosum C的表达,并增加了对UVR的黑色素瘤细胞敏感性。抑制NCOA3表达导致激活DDR效应,降低细胞周期蛋白B1的表达,导致G2 / M抑制和有丝分裂灾难。
一个单核苷酸多态性NCOA3 (T960T)与黑色素瘤风险降低相关,在家族性黑色素瘤队列中发病率明显低于无癌症的对照组。其他研究表明,这种多态性降低了NCOA3蛋白的产生,并伴随着对紫外线的敏感性增加,从而导致细胞死亡。
综上所述,这些发现与暴露于紫外线照射后NCOA3表达升高促进黑素细胞存活的黑素瘤起始模型一致。这种生存优势使紫外线介导的DNA损伤得以积累。在黑色素瘤易感个体的一生中,大量暴露于紫外线照射可导致高突变负担和不受控制的细胞增殖,这是该疾病的特征。相比之下,这些作用在T960T多态性表达后减弱,增加了对紫外线介导的细胞死亡的敏感性,从而保护抗紫外线致癌作用。
“我们的研究结果表明,一种分子标记物在肿瘤进展的不同阶段具有前所未有的作用。这些结果确定NCOA3作为黑色素瘤的候选易感标记物,作为一个潜在的诊断标记物,作为黑色素瘤生存的预后标记物,并作为治疗的靶点。我们认为NCOA3在紫外线介导的黑色素瘤发生中发挥关键作用,并作为黑色素瘤的合理治疗靶点,”Kashani-Sabet博士说。
皮肤癌是世界上最常见的癌症类型。黑色素瘤约占皮肤癌的1%,但却是绝大多数皮肤癌的病因皮肤癌人死亡。今年,大约有106000名美国人被诊断出患有黑色素瘤。
卡沙尼-萨比特博士说:“我们致力于推进这项研究,帮助指导和告知患有黑色素瘤的萨特患者和世界各地的其他患者的治疗。”
进一步探索













用户评论