六种以前的FDA批准的药物似乎在实验室测试中对SARS-COV-2进行了很有希望
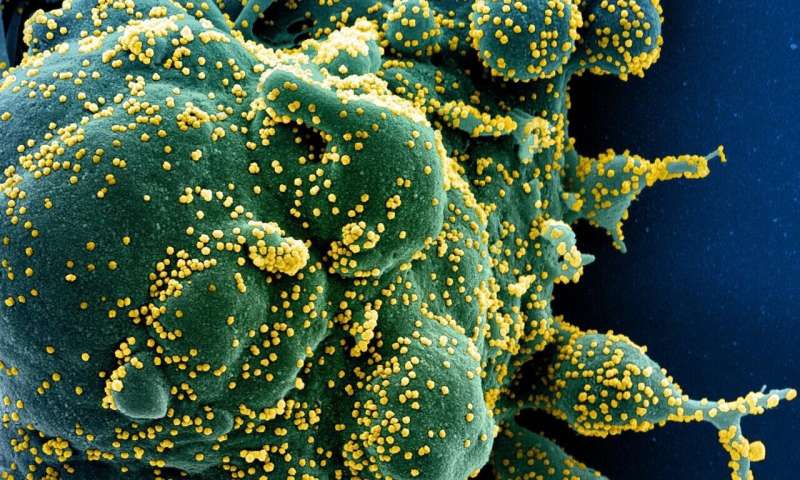
来自中华民国的调查员组织发现,6种药物以前批准的美国食品和药物管理局(FDA)对于其他适应症,可以重新批准治疗或预防Covid-19。该研究发表在抗微生物剂和化疗是美国微生物学会杂志。
使用FDA批准的药物节省时间 - 药物不需要通过FDA批准过程,使其能够迅速提供,以治疗需要它们的患者。
该研究表明,调查人员筛选了2个大药品累积含有3,769名FDA批准的药物的文库,发现可以抑制2种蛋白切割酶,称为蛋白酶的药物,这对于SARS-COV-2的复制至关重要。
用于测试药物的测定涉及在培养皿中生长病毒,将每个药物应用于不同的药物培养皿含有病毒,然后进行斑块还原测定以确定每个药物的有效性。原始爆发菌株Clade S用于测定中。('Clade'是家族群体的技术术语。)
通过通讯作者Po-Huang Liang,Ph.D.的研究人员,也计划将药物视为占主导地位的GR菌株,这是第一个出现的变种,在1月下旬或2月,2020年,最近,最近的具有传染性的英国菌株。梁博士是中国中华民国学院生物化学研究所研究所和教授。
他们的研究也使调查人员能够更好地了解如何新冠病毒蛋白酶在复制过程中识别它们的基质。这将有助于他们调整他们识别的药物更有效的抑制剂蛋白酶。
“尽管病毒的变化菌株多年来,考虑到3CL蛋白酶在病毒复制中的意义,以及这种蛋白质目标对突变的相对较低的可能性,我们的目标是使用我们的平台开发广谱的抗病毒药物,有助于防止未来的出现致病性SARS-COV菌株,“梁博士说。
梁博士的小组开始在18年前爆发原始SARS病毒的爆发期间致力于其中一名蛋白质,称为3 Clpro。那时,Coauthor Chih-Jung Kuo是梁博士的博士。学生,研究是他博士学位的主题。论文。Kuo博士现已在中华民国台湾国民涌兴大学兽医部门副教授。













用户评论