确定了β -淀粉样蛋白的直接毒性作用

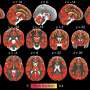
大脑特定区域的过度活跃神经元被认为是阿尔茨海默病的早期扰动。来自慕尼黑工业大学(TUM)的一个团队第一次能够解释这种早期且因此重要的神经元功能障碍的原因和机制。他们发现兴奋性神经递质谷氨酸在活跃神经元附近持续时间过长。这会导致这些神经元的病态过度刺激——极有可能导致阿尔茨海默病患者学习能力受损和记忆丧失。
已经出现临床症状的阿尔茨海默病患者的大脑中含有大块的β -淀粉样蛋白,即斑块。许多治疗方法侧重于去除斑块,但迄今为止,这种尝试只取得了有限的成功。
“我们尽早发现并治疗这种疾病至关重要。因此,我们专注于过度活跃的神经元,这发生在非常早期的阶段,远早于患者的发展记忆丧失德国TUM Hertie神经科学高级教授Arthur Konnerth教授解释道。过度激活的结果是,回路中连接的神经元不断接收虚假信号,导致信号处理受损。
Konnerth和他的博士生Benedikt Zott以及整个研究团队一起,成功地确定了这种早期大脑紊乱的原因和触发因素。这一发现可能为新的治疗方法开辟道路。这项研究发表在杂志上科学.
β -淀粉样蛋白阻断谷氨酸的再摄取
神经元使用一种叫做神经递质的化学物质来相互交流。谷氨酸是这些化学物质中最重要的一种,用于激活连接的神经元。谷氨酸被释放在两个神经元之间的连接部位,称为突触,然后被迅速移除,以允许下一个信号的传输。这种去除包括所谓的主动泵分子以及被动的转运谷氨酸沿着附近的膜。
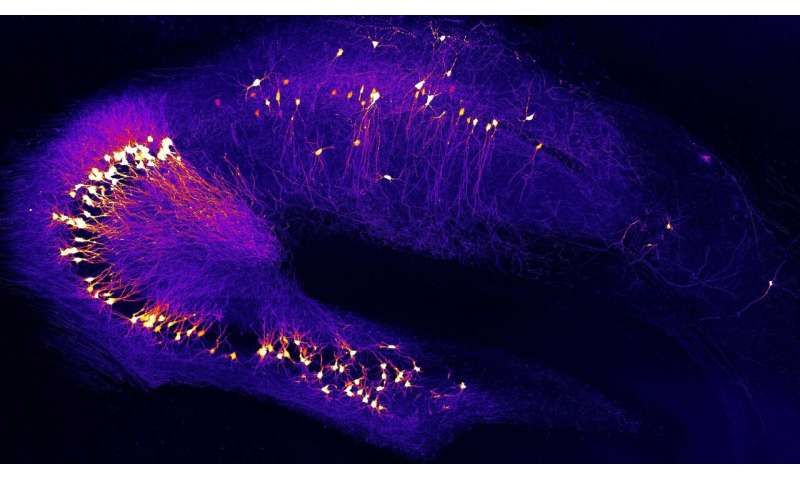
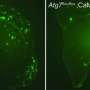
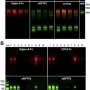
研究人员发现,高浓度的谷氨酸在过度活跃的突触间隙中持续时间过长神经元.这是由于β -淀粉样蛋白分子的作用,它阻止了谷氨酸盐从突触间隙运输出去。研究小组使用来自患者样本的β -淀粉样蛋白分子和使用各种小鼠模型测试了这一机制,两种方法都得到了相似的结果。
早期治疗策略的指示
研究小组还好奇地发现,神经递质阻断是由早期可溶性的β -淀粉样蛋白介导的,而不是由斑块介导的。淀粉样蛋白最初以单分子形式或单体形式出现,然后聚集成双分子形式(二聚体)和更大的链,最终形成斑块。研究人员发现谷氨酸阻断是由可溶性二聚体引起的。
“我们的数据提供了明确的证据,证明某种特定物质会产生快速而直接的毒性作用β-淀粉样蛋白类型,二聚体。我们甚至能够解释这种机制,”该研究的第一作者本尼迪克特·佐特(Benedict Zott)概述道。研究人员现在希望利用这些知识来进一步提高他们对阿尔茨海默病细胞机制的理解,从而支持在疾病早期阶段治疗策略的发展。
进一步探索