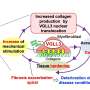
先天性心脏病的危险因素可能是内部和外部的心
先天性心脏病(chd)出生defect-related死亡的主要原因。了解基因改变引起这样的缺陷是复杂的事实,许多关键的基因是未知的,和那些被经常贡献仅小幅增加冠心病的风险。
在一项新的研究发表在开放获取期刊9月8日公共科学图书馆生物学,加州大学欧文分校的生物学家安妮Calof和亚瑟着陆器和同事们报告基因在冠心病中的作用比以前更复杂和意识到整体风险是由基因的结合影响内外的心脏本身。
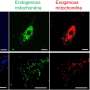
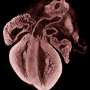
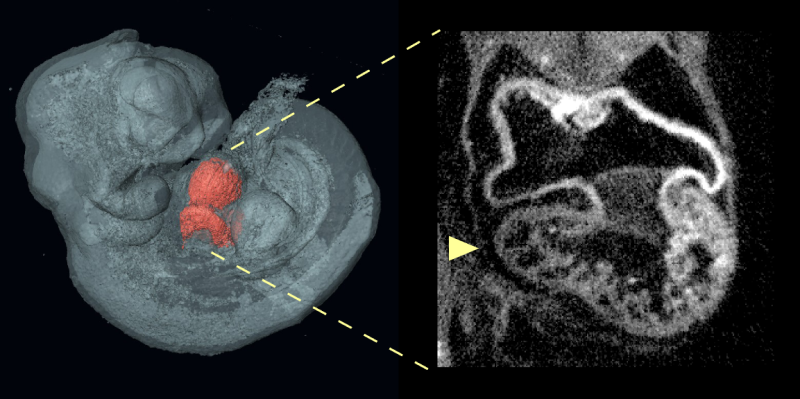
正常心脏的形成取决于交互的多种类型的细胞,在准确的时间和地点在发展合作建立心脏的错综复杂的结构。找出这些交互可能出错,Calof-Lander团队研究心房间隔缺损(asd,常见的心脏缺陷)小鼠模型的发展障碍科妮莉亚德兰格综合症(情况)。
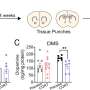
大多数情况下的科妮莉亚德兰格综合症是由突变引起Nipbl灭活一个副本,一个基因引导许多数以百计的其他基因的表达在人体组织。正如科妮莉亚德兰格综合症患者有心脏缺陷发生率高,30%的老鼠港类似Nipbl突变表现出心房中隔缺损。
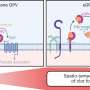
使用转基因小鼠模型,研究人员使用一种新的技术来选择性地介绍或删除Nipbl变异在不同组织在胚胎发育期间。出人意料地,他们发现没有Nipbl缺乏任何单一tissue-including组织形式心脏本身可能是心房中隔缺损的发展。相反,心脏缺陷的发展是由heart-forming组织之间的相互作用和身体的其他部位。事实上,有些组织甚至似乎缺乏Nipbl防止心房中隔缺损的发展,在某些情况下。
在底漆的一篇文章中伴随这项研究,布鲁斯Gelb,医学博士,从伊坎在西奈山医学院,解释了为什么这些“令人费解的结果”,写道,“这个工作提供了新颖的见解不完全外显率和寡基因影响潜在冠心病。”He adds that the novel observations "add further complexity to the way in which we need to think about CHD pathogenesis".
“我们的研究结果让我们假设心脏缺陷,如自闭症发生在心脏没有快速增长足以满足发展的要求身体——换句话说,心脏大小和身体大小必须协调发展对心脏没有缺陷,“Calof说,解剖学和神经生物学和发育和细胞生物学教授在UCI。“据我们所知,这是第一个基因示范重大风险因素心脏缺陷心脏本身的可能之外。”
“当一个单基因改变引起出生缺陷,我们常常认为这是因为一件事在一个细胞类型出错。最大的不同在我们的研究可能与事实Nipbl控制大量的其他基因,”唐纳德·布伦教授兰德说发育和细胞生物学和UCI中心主任复杂的生物系统。“鉴于大多数人类冠心病现在被认为是由基因变异引起的行动组合,我们从Nipbl-deficient老鼠可能是更典型的大多数冠心病出现。”
更多信息:公共科学图书馆生物学,dx.doi.org/10.1371/journal.pbio.2000197