研究人员发现分子引发的炎症性肠病
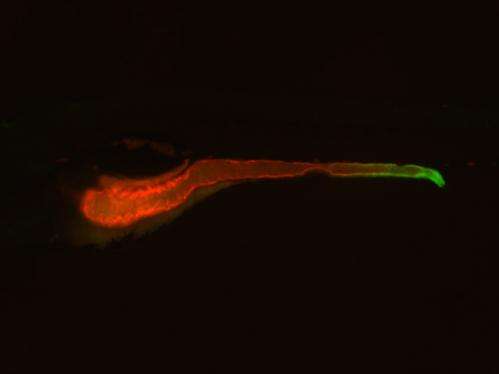
肠道的内皮细胞形成一个重要障碍,保护我们的身体免受细菌的数十亿生活在肠道。违反这一障碍主要是由一个信号分子称为所驱动的肿瘤坏死因子(TNF),高数量的与炎性肠道疾病相关,如克罗恩病和溃疡性结肠炎。
药物靶向肿瘤坏死因子已经成为一个有效的治疗这些疾病,但尽管它的临床的重要性,目前仍不清楚引发肠道肿瘤坏死因子水平增加,或如何事件会导致疾病的发生。
杜克大学的研究人员现在已经发现,一个基因称为uhrf1就像一种分子手闸TNF。在缺乏uhrf1, TNF推出一系列促炎症和免疫信号和损伤消化道火上浇油。
“我们的发现提供了新的炎性肠道疾病如何出现和发展,”米歇尔Bagnat说,博士,助理教授杜克大学医学院细胞生物学。“我们已经知道,遗传易感性可能发挥作用,但我们发现这不仅仅是免疫基因本身,而且这些基因(通过表观遗传学)的监管,这可能会导致一些问题。”
这些发现出现2月16日的一周美国国家科学院院刊》上。
炎症性肠病(IBD)是一组胃肠道慢性疾病的影响超过160万美国人。虽然这些疾病的起源尚不清楚,最近的研究涉及许多因素,包括遗传变异,肠道微生物、过分活跃的免疫和环境暴露。
Bagnat决定使用一个实验性的方法称为“正向遗传学发现新的炎症性肠病的原因。首先,他的博士后林赛马郁兰使用化学物质诱导突变的生物模型的选择,斑马鱼。因为这些小水族馆鱼类胚胎透明,她可以很容易地想象任何缺陷在肠道。
数以百计的突变体进行筛选后,马郁兰发现几株显示明显的缺陷,包括薄保护屏障和块漂浮的细胞碎片。
接下来,研究人员决定缩小他们的结果只有突变体参与炎症。因为TNF活性是炎症的一个特点,他们创造了一个“记者”斑马鱼照亮绿色无论TNF基因是“打开”的生物。然后研究人员培育TNF记者鱼突变体的初始屏幕,看看任何突变基因的影响这一重要炎性分子的表达。
实验取得了两大惊喜。首先,他们发现,肿瘤坏死因子,最初被认为是主要由免疫细胞产生的,也是由行肠的上皮细胞。第二,他们发现其中一个突变体实际泵产生肿瘤坏死因子的水平消化道。
经过更多的遗传的调查,研究人员发现基因是uhrf1,参与一个表观遗传过程称为DNA甲基化。是否一个特定的基因被“关闭”或“on”在一个给定的细胞是由特定的化学标记的存在与否或甲基groups-methylation-attached DNA。
Uhrf1通常行为关闭产生肿瘤坏死因子的基因,但是当镇压了,这些基因被打开和TNF制造和释放。“你可以想想的汽车停在车道上。如果你摆脱拉手闸,汽车开始滚动,”Bagnat说。
与玛丽Goll纪念斯隆-凯特琳癌症中心的研究人员证明,失去uhrf1确实删除从TNF基因甲基化。
接下来,Bagnat转向他的杜克大学的同事约翰·罗尔斯探索的勇气是否斑马鱼必须暴露在细菌引起肿瘤坏死因子的促炎症活动。当他们提出了斑马鱼突变体在无菌环境中,肿瘤坏死因子仍激活,但程度。结果表明,失去uhrf1足够的刹车头TNF在毁灭的过程,即使没有额外的推动从肠道微生物。
现在,研究人员正试图把他们的发现人类这样的高级生物体通过寻找类似的IBD患者甲基化缺陷。最终,他们找到的缺陷可以提供目标的新诊断或治疗疾病。
进一步探索






用户评论