新的研究揭示大脑细胞如何降低危险的蛋白质聚合
理研大脑科学研究所的研究人员(BSI)发现了一个关键机制负责选择性降解ubiquitinated蛋白质从细胞的聚集。他们的研究结果表明,骨料的捕捉和删除是介导的磷酸化蛋白质称为p62,打开门新方法治疗神经退行性疾病,如亨廷顿氏舞蹈病和阿尔茨海默氏症。
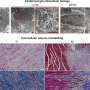
细胞最重要的活动之一是蛋白质的生产,发挥重要功能从氧运输、免疫防御、食物消化。与细胞的生存同样重要的是如何处理这些蛋白质时,通过他们的截止日期:损坏或错误折叠的蛋白质与一系列相关会使身体状况日益衰弱的疾病,包括神经退行性疾病如阿尔茨海默氏症。
在真核细胞,破坏或misformed蛋白质的回收是由一个小调节蛋白称为泛素这一过程被称为“泛素化”。附着在蛋白的泛素分子可以标记蛋白水解酶的破坏,大蛋白复合物中蛋白质降解和回收不需要的细胞。这种回收的蛋白质水解酶的维护是至关重要的细胞内稳态。
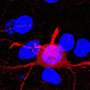
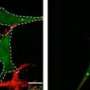
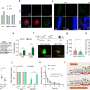
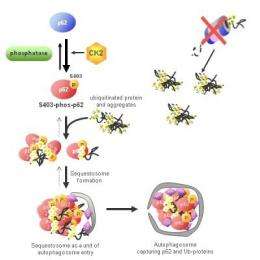
与他们的研究,BSI研究小组试图阐明一个领域proteasome-based回收不足:蛋白复合物或聚合,水解酶降解有困难。组显示这个弱点的丝氨酸的磷酸化的蛋白质称为p62 403 (S403)位点ubiquitin-associated(非洲联合银行)领域,触发一个异化的过程被称为选择性自噬降解蛋白质总量。它通过形成一个“sequestosome”,这一结构扣押polyubiquitinated蛋白质聚集在准备自噬。
发表在《分子细胞,这种机制的发现开启了大门的发展新的、更有效的药物选择性地降解蛋白质聚集,应用前景的治疗一系列神经退行性疾病。